助力研究院实现 GMP 合规、全流程可追溯、高效协同的实验记录管理体系
在药品研发与生产过程中,实验数据的真实性、完整性与可审计性是质量管理的核心要求。传统纸质记录方式存在易篡改、难追溯、归档繁琐等问题,难以满足日益严格的 GMP 法规和监管审查需求。
为此,我们携手研究院打造了 “实验室电子相册” 系统 —— 一套基于钉钉生态构建的轻量化、高合规、全流程闭环的实验数据采集与审核平台,全面替代手工拍照+Excel登记模式,推动科研管理迈向数字化、标准化、智能化。
✅ 合规保障:全流程留痕,自动加水印、防篡改,符合 ALCOA+ 数据完整性原则
✅ 效率提升:审核人员可通过钉钉卡片直接审批,响应速度提升 60% 以上
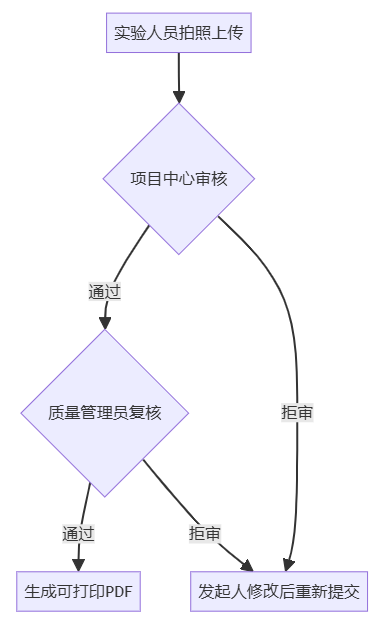
✅ 流程闭环:拍照 → 定位 → 提交 → 双级审核 → 复核 → 打印归档,全过程线上化
✅ 审计便捷:支持操作日志追踪、PDF带二维码跳转详情,轻松应对内外部审计
系统深度融合钉钉组织架构与消息能力,采用“小程序 + 卡片消息 + PC后台”三位一体设计:
钉钉小程序:一线实验人员实时拍照上传,无感登录,操作极简
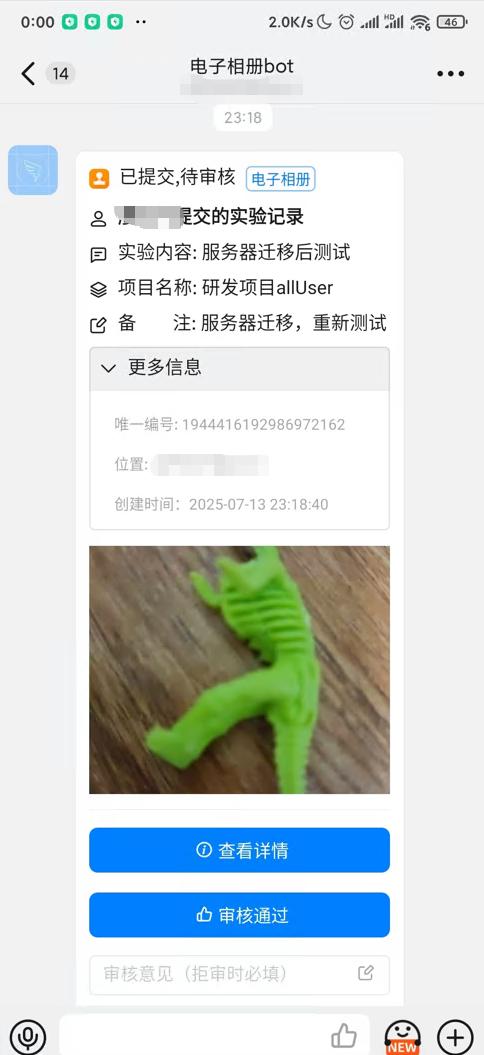
钉钉卡片消息:关键节点推送待办任务,支持审核人“无需打开应用”快速处理
网页管理端:管理员进行项目配置、权限分配、用户管理与日志审计
服务端与数据库:由IT统一维护,保障数据安全与系统稳定
所有照片均强制实时拍摄,并自动附加时间、地点、操作人、设备ID等元信息水印,杜绝数据造假风险。
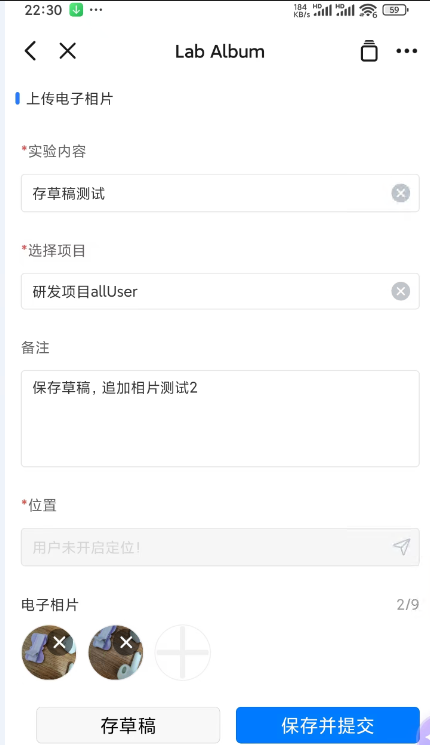
实验数据采集:实验员现场拍照上传,系统自动记录 GPS 位置与时间戳,确保每一条数据真实可信。
多级审核机制:支持“项目中心初审 + 质量管理员复核”双层控制,关键环节必须填写拒审意见,形成完整证据链。
智能打印归档:复核通过后生成带防伪水印和动态二维码的 PDF 文件,扫码即可回溯原始记录,便于档案调阅与审计追踪。
高效团队协作:支持多项目、多角色权限隔离管理,仅项目成员及相关审核方可查看对应数据,保障信息安全。
✅ 新增草稿功能:支持分次拍摄、暂存草稿,拒审后可修改再提交,避免重复劳动。
✅ 打印表单增加二维码:钉钉扫码直达电子记录页面,打通线上线下数据断点。
✅ 增加一级审核模式(可选):针对非关键项目,可配置为“仅由质量管理员单级审核”,灵活适配不同业务场景。
✅ 修复多项体验问题:优化安卓兼容性、网络异常处理机制,提升系统稳定性。
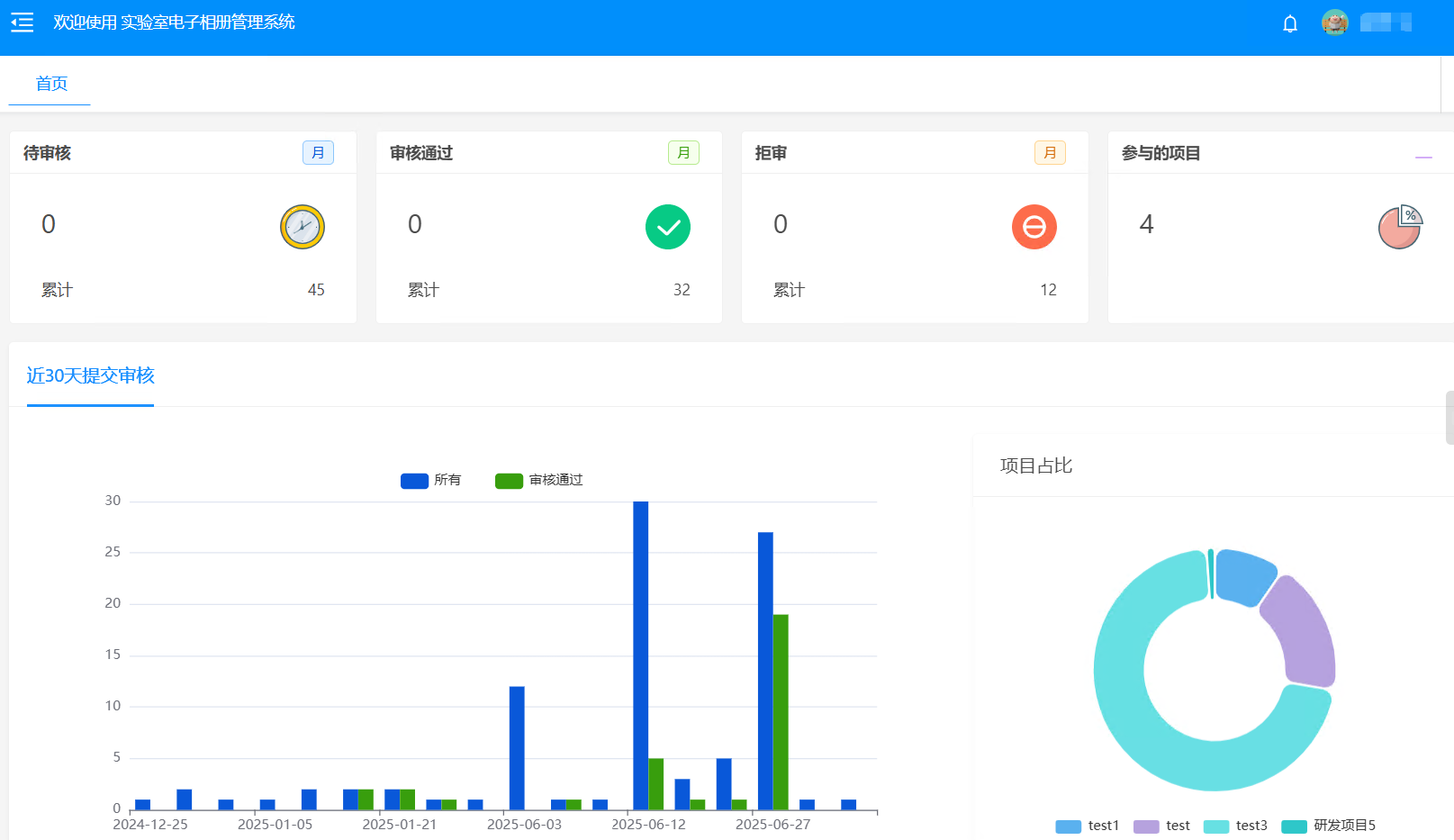
审核平均响应时间:缩短至 2小时内(原平均8小时)
表单错误率:下降 75%
归档效率:提升 3倍,支持一键导出PDF
审计准备周期:从3天缩短至 实时调取
“以前每次迎检都要花几天整理材料,现在扫码就能看到全过程,真正做到了‘数据说得清、过程可追溯’。”
—— 研究院 QA 主管